Преглед
Брза идентификација на трансгенски растенија
Текст/Тонг Јученг
Експериментална операција/Хан Јинг
Уредник/Вен Јуџун
Зборови/1600+
Предложено време за читање/8-10 минути
Брза идентификација на трансгенски растенија
Како новодојденец во лабораторијата, не е добра работа да се отстранат позитивните растенија од куп растенија со ниска стапка на конверзија.Прво, ДНК мора да се извлече од голем број примероци еден по еден, а потоа странските гени ќе бидат откриени со PCR.Сепак, резултатите често се празни и ленти со неколку ставки повремено, но невозможно е да се утврди дали има пропуштени или лажни откривања..Дали е многу беспомошно да се соочиш со таков експериментален процес и резултати?Не грижете се, брат ве учи како лесно и прецизно да ги прегледате трансгенските позитивни растенија.
Чекор 1: Прајмери за откривање дизајн
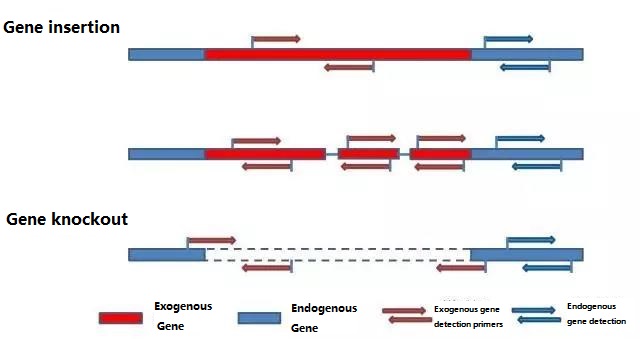
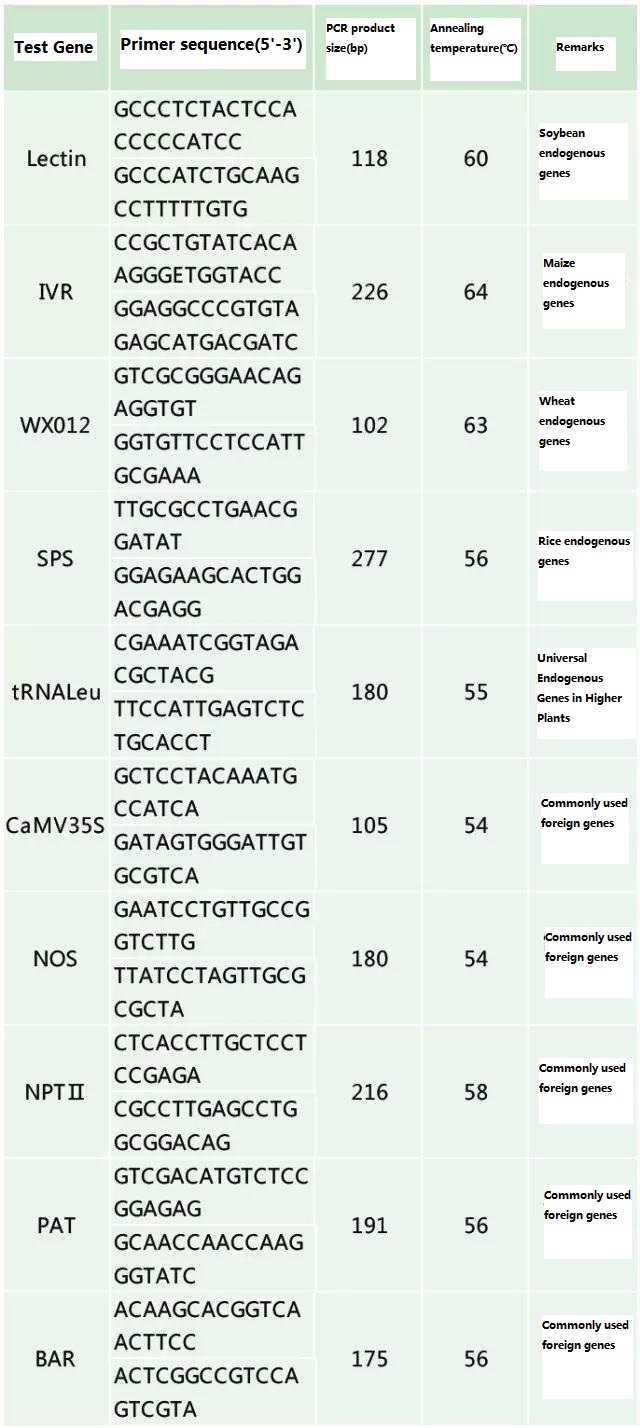
Одредете го ендогениот ген и егзогениот ген што треба да се детектираат според примерокот што треба да се тестира и изберете репрезентативна секвенца од 100-500 bp во генот за дизајн на прајмер.Добрите прајмери можат да обезбедат точност на резултатите од откривањето и да го скратат времето на откривање (видете го додатокот за најчесто користените прајмери за откривање).
Забелешка:
Новодизајнираните прајмери треба да ги оптимизираат условите на реакцијата и да ја потврдат точноста, прецизноста и границата на откривање на детекцијата пред да извршат откривање од големи размери.
Чекор 2:Развијте експериментален протокол

Позитивна контрола: Користете ја прочистената ДНК што го содржи целниот фрагмент како шаблон за да одредите дали системот и условите за реакција на PCR се нормални.
Негативна/празна контрола: Користете шаблон за ДНК или ddH2O што не го содржи целниот фрагмент како шаблон за откривање дали има извор на контаминација во PCR системот.
Внатрешна референтна контрола: користете ја комбинацијата на прајмер/сонда на ендогениот ген на примерокот што треба да се тестира за да се оцени дали шаблонот може да се открие со PCR.
Забелешка:
За секој тест треба да се постават позитивни, негативни/празни контроли и контроли за внатрешна контрола за да се оцени валидноста на експерименталните резултати.
Чекор 3: Подготовка за експеримент

Пред употреба, погледнете дали растворот е рамномерно измешан.Доколку се најдат врнежи, тие треба да се растворат и измешаат според упатствата пред употреба.2×PCR мешавината треба да се пипетира и постојано да се меша со микропипета пред употреба за да се избегне нерамномерна дистрибуција на јони.
Забелешка:
Извадете ги упатствата и внимателно прочитајте ги и подгответе се пред експериментот во строга согласност со упатствата.
Чекор 4: Подгответе го системот за реакција на PCR
Според експерименталниот протокол, измешајте ги прајмерите, H2O, 2×PCR измешајте, центрифугирајте и дистрибуирајте ги во секоја реакциона цевка.
Забелешка:
За големи или долгорочно тестирање, се препорачува да се користи систем за реакција на PCR кој содржи ензим UNG, кој може ефикасно да избегне контаминација на аеросол предизвикана од производите на PCR.
Чекор 5: Додадете образец за реакција

Со користење на Direct PCR технологијата, нема потреба од мачен процес на прочистување на нуклеинската киселина.Шаблонот на примерокот може да се подготви во рок од 10 минути и да се додаде во соодветниот систем за реакција на PCR.
Забелешка:
Методот Lysis има подобар ефект на откривање, а добиениот производ може да се користи за повеќекратни реакции на детекција.
5.1: Директна PCR на листовите
Според големината на сликата во упатството, исечете го листовото ткиво со дијаметар од 2-3 mm и ставете го во системот за реакција на PCR.
Забелешка: Осигурете се дека фрагментите од листот се целосно потопени во растворот за реакција на PCR и не додавајте прекумерно ткиво на листот.
5.2: Метод на лиза на листот
Исечете го лисното ткиво со дијаметар од 5-7 mm и ставете го во цевка за центрифуга.Ако изберете зрели лисја, избегнувајте да ги користите ткивата на главната вена на листот.Пипетирајте 50 ul пуфер P1 лизат во цевка со центрифуга за да се осигурате дека лизатот може целосно да го потопи ткивото на листот, ставете го во термички циклус или метална бања и лиза на 95°C 5-10 минути.


Додадете 50 ул. раствор за неутрализација на пуфер P2 и добро измешајте.Добиениот лизат може да се користи како шаблон и да се додаде во системот за реакција на PCR.
Забелешка: Количеството на шаблонот треба да биде помеѓу 5-10% од PCR системот и не треба да надминува 20% (на пример, во PCR систем од 20μl, додадете 1-2μl пуфер за лиза, не повеќе од 4μl).
Чекор 6: Реакција на PCR

Откако ќе ја центрифугирате цевката за реакција на PCR, ставете ги во PCR инструмент за засилување.
Забелешка:
Реакцијата користи непрочистен шаблон за засилување, така што бројот на циклуси на засилување е 5-10 циклуси повеќе отколку кога се користи шаблон за прочистена ДНК.
Чекор 7: Откривање на електрофореза и анализа на резултатите

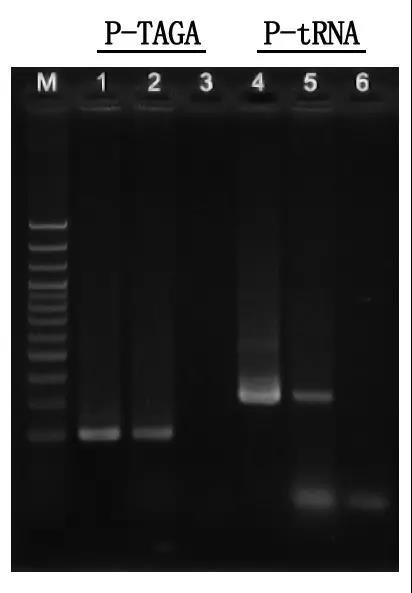
М: 100bp ДНК скалила
1\4: Метод на прочистена ДНК
2\5: Директен метод на PCR
3\6: Празно контрола
Контрола на квалитет:
Резултатите од тестот на различните контроли поставени во експериментот треба да ги исполнуваат следните услови.Во спротивно, треба да се анализира причината за проблемот, а тестот да се направи повторно откако ќе се отстрани проблемот.
Табела 1. Нормални резултати од тестот на различни контролни групи

*Кога плазмидот се користи како позитивна контрола, резултатот од тестот за ендогени гени може да биде негативен
Пресуда на резултатот:
A. Резултатот од тестот на ендогениот ген на примерокот е негативен, што покажува дека ДНК погодна за обична PCR детекција не може да се екстрахира од примерокот или екстрахираната ДНК содржи инхибитори на PCR реакција, и ДНК треба повторно да се екстрахира.
Б. Резултатот од тестот на ендогениот ген на примерокот е позитивен, а резултатот од тестот на егзогениот ген е негативен, што покажува дека ДНК погодна за обична PCR детекција е извлечена од примерокот и може да се процени дека генот ХХХ не е откриен во примерокот.
В. Резултатот од тестот на ендогениот ген на примерокот е позитивен, а резултатот од тестот на егзогениот ген е позитивен, што покажува дека ДНК погодна за обична PCR детекција е извлечена од примерокот, а примерокот ДНК го содржи генот ХХХ.Експериментите за потврда може дополнително да се спроведат.
Чекор 8: Дизајн прајмери за откривање

По експериментот, користете 2% раствор на натриум хипохлорит и 70% раствор на етанол за да ја избришете експерименталната област за да спречите загадување на животната средина.
Додаток
Табела 2. Најчесто користени прајмери за општа PCR детекција на генетски модифицирани растенија
Референтен документ:
SN/T 1202-2010, Квалитативен метод за откривање PCR за генетски модифицирани растителни состојки во храната.
Министерство за земјоделство Објава 1485-5-2010, Тестирање на состојките на генетски модифицираните растенија и нивните производи-ориз М12 и неговите деривати.
Време на објавување: Јуни-09-2021 година








